|
| Fluxul de Stiri dupa Data Aparitiei |
|
Comentarii Adauga Comentariu _ Descoperirea unui subset de introni umani scurti care sunt îmbinați printr-un mecanism nou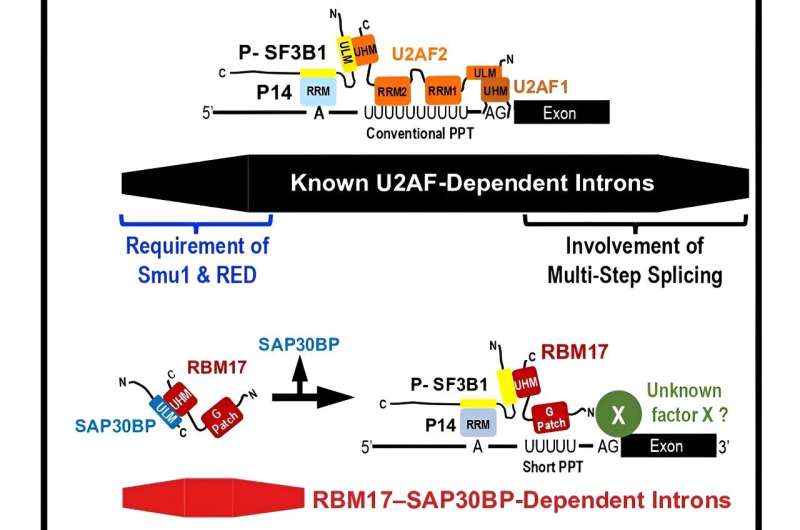 _ Descoperirea unui subset de introni umani scurti care sunt desprinși printr-un mecanism nouBien-cunoscutul heterodimer U2AF esențial de pre-mRNA de splicing (U2AF2–U2AF1) a fost identificat ca mediator al reacțiilor de splicing timpurie la toți intronii de diferite lungimi . Cu toate acestea, dr. Kazuhiro Fukumura din laboratorul Akila Mayeda de la Universitatea de Sănătate Fujita a descoperit că un subset de introni scurti cu tracturi de polipirimidină trunchiate sunt îmbinați de complexul RBM17-SAP30BP în loc de heterodimer U2AF. Echipa Dr. Fukumura a propus un mecanism unic în care SAP30BP ghidează RBM17 către spliceozomi activi timpurii. La om, lungimea pre-ARNm variază foarte mult (de la 30 la 1.160.411 de nucleotide după studii recente). Mecanismul fundamental al splicing-ului a fost studiat cu modele de pre-mARN, inclusiv introni de 158 și 231-nt, de exemplu, care sunt splicing foarte eficient in vitro și in vivo. Un astfel de pre-mARN ideal conține secvențe semnal de îmbinare bune, adică site-ul de îmbinare 5′, secvența locului de ramificare (BS) și tractul polipirimidinic (PPT) urmat de situsul de îmbinare 3′ care sunt recunoscute de U1 snRNP, U2 snRNP și U2AF2–U2AF1, respectiv. Prof. Mayeda spune: „Având în vedere lungimile diverse ale intronilor umani, este probabil să existe mai mult de un mecanism. Aceasta este motivația noastră de a iniția studiul nostru de îmbinare axat pe intronii umani scurti.” Dr. Fukumura explică: „Cercetarea noastră anterioară asupra procesului de îmbinare pe intronul scurt a dezvăluit că factorul de îmbinare autentic U2AF2 nu se poate lega de PPT trunchiat și apoi RBM17 este înlocuit cu U2AF pentru a promova îmbinarea. Știi, acest lucru este rezonabil, deoarece intronii scurti sunt adesea prea mult. strâns pentru lungimea suficientă a PPT. Am publicat această constatare în 2021. „Cu toate acestea, RBM17 nu se poate lega de PPT-ul trunchiat in vitro, așa că nu știam cum PPT-ul trunchiat și următoarea îmbinare de 3′ site-ul sunt recunoscute de RRM17. Prin urmare, am emis ipoteza că un alt factor proteic este implicat în splicing-ul dependent de RBM17.” Grupul Mayeda a identificat în cele din urmă acest cofactor proteic din spatele splicing-ului dependent de RBM17, care este SAP30BP. Studiul lor a fost publicat în revista jurnalul Cell Reports din 7 decembrie 2023. Dr. Fukumura afirmă: „A fost esențial să investighem referințele anterioare. Din trei lucrări, am fost convins că SAP30BP este cel mai puternic candidat pentru cofactorul RBM17." Ei au arătat că existența SAP30BP în complexul uman de îmbinare timpurie, musca fructelor SAP30BP și RBM17 au fost detectate în spliceosome de muscă format pe un intron scurt. , iar legarea dintre SAP30BP și RBM17 a fost într-adevăr detectată prin analiza cu doi hibride a drojdiei. „În zilele noastre, epuizarea SAPBP mediată de siRNA în linia celulară umană este modalitatea simplă și simplă de a verifica reprimarea RBM17- îmbinare dependentă. Și a fost bingo!” spune dr. Fukumura. Transcrierile din celulele umane epuizate de SAP30BP au fost analizate cu un secvențior de generație următoare (analiza ARN-Seq) și mulți introni dependenți de RBM17 și SAP30BP. Acești introni au fost distribuiți în intervalul mai scurt și PPT-ul trunchiat a fost într-adevăr un determinant critic al dependenței RBM17/SAP30BP. Astfel, RBM17 și SAP30BP sunt factorii generali de îmbinare. Prof. Mayeda remarcă , „A fost o coincidență norocoasă că Prof. Michael Sattler, care este un expert în analize structurale, a fost profund interesat de studiul nostru și am putea începe o colaborare productivă.” Interacțiuni proteine-proteine prin UHM (Motivul de omologie U2AF) – Legarea ULM (motivul UHM-ligand) joacă roluri esențiale în reacțiile generale de splicing.Laboratorul Sattler a găsit o secvență ULM ascunsă în SAP30BP și a demonstrat că acest lucru este esențial pentru a interacționa cu UHM în RBM17 prin RMN (magnetic nuclear). rezonanță) și analize ITC (calorimetrie de titrare izotermă). Cu toate acestea, rolul interacțiunii RBM17-SAP30BP a rămas enigmatic. Deoarece RBM17 are un singur UHM, legarea RBM17-SAP30BP trebuie eliberată înainte de interacțiunea RBM17 cu SF3B1, o componentă a snRNP U2, care este esențială pentru a promova îmbinarea. Deci, care este rolul interacțiunii RBM17–SAP30BP? Prof. Mayeda spune: „Fukumura a conceput un test de legare inteligentă folosind anticorpi anti-fosfo-SF3B1 pentru a aborda această întrebare curioasă și am putea oferi un model de lucru elegant.” Cercetătorii propun ca intermediarul complex RBM17–SAP30BP. previne legarea RBM17 nefuncțională de SF3B nefosforilat liber, ceea ce promovează legarea RBM17 funcțională de SF3B1 fosforilat activ pe pre-ARNm.
Linkul direct catre PetitieCitiți și cele mai căutate articole de pe Fluierul:
|
|
|
Comentarii:
Adauga Comentariu